Physik Oberstufe/ Quantenphysik/ Kernphysik
Aufbau und Eigenschaften des Atomkerns

Die Nukleonen: Proton und Neutron
Seit den Streuexperimenten Rutherfords wissen wir: Der Atomkern ist sehr klein, positiv geladen und vereinigt in sich fast die gesamte Masse des Atoms. Genauere Untersuchungen ergeben: Der Kerndurchmesser liegt im Bereich einiger Femtometer (), er ist damit rund 100000 mal kleiner als das Atom. Er ist aus Nukleonen, das sind positiv geladene Protonen und elektrisch neutrale Neutronen, aufgebaut. Ein Nukleon ist dabei fast 2000 mal schwerer als ein Elektron. Zum Vergleich ist in der Tabelle neben den Nukleonen auch noch das Elektron aufgeführt:
| Proton | Neutron | Elektron | |
|---|---|---|---|
| Masse | |||
| Ladung | |||
| Durchmesser | Punktförmig () |
Kerne aus Nukleonen

Wir können nun aus den Nukleonen Atomkerne zusammensetzen. Dabei findet man, dass zur Bildung eines stabilen Atomkerns mit vorgegebener Kernladungs(an)zahl Z von Protonen ungefähr dieselbe Anzahl von Neutronen erforderlich ist. (Bei schweren Kernen sind sogar noch mehr Neutronen erforderlich). Um einen Kern anzugeben, verwendet man folgende Notation:
- .
Dabei ist Z die Kernladungszahl (auch Ordnungszahl) und A die Massenzahl. Elementsymbol und Kernladungszahl Z sind dabei redundant, oft wird nur die Massenzahl A und das Element(symbol) angegeben. Für die Neutronenzahl N gilt damit:
- .
Die chemischen Eigenschaften eines Elements sind vollkommen durch die mit der Kernladungszahl Z festgelegte Elektronenhülle vorgegeben.
Isotope
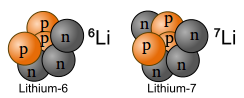
Die Anzahl der Neutronen kann für einen stabilen Kern in gewissem Rahmen variieren, d.h. von einem Element kann es verschiedene sog. Isotope geben, die sich allein durch die Anzahl N der Neutronen im Kern (und damit in der Atommasse) unterscheiden. Dieser Unterschied hat auf die chemischen Eigenschaften des jeweiligen Elements aber (fast) keinen Einfluss. In der folgenden Tabelle sind einige bekannte Isotope der einfachsten Atomsorten aufgeführt:
| Name | Wasserstoff | Deuterium | Tritium | Helium | Lithium | |
|---|---|---|---|---|---|---|
| Notation | ||||||
| Kern | 
|
|
| |||
Die Entdeckung Radioaktiver Strahlung


Die Entdeckung der Radioaktivität im ausgehenden 19. Jahrhundert durch Antoine Henri Becquerel hat in großem Maße zum Verständnis des Atoms und seines Kerns beigetragen. Sie fällt in den Zeitraum der Entdeckung von Röntgenstrahlung und ist eng mit der modernen Physik verknüpft. Es empfiehlt sich als Lektüre ein Überblick über die Entdeckung.
Eigenschaften Radioaktiver Strahlung


Mit der Entdeckung einer unbekannten Strahlung stellt sich die Frage nach ihren Eigenschaften. Wie kann man diese untersuchen?
- Reichweite, Durchdringungsvermögen → Aufschluss über mögliche Bestandteile
- Ablenkung in elektrischen/magnetischen Feldern → Aufschluss über möglich Ladung
- Energieverteilung → Erkenntnisse über Entstehungsprozesse und beteiligte Komponenten
| -Strahlung | -Strahlung | -Strahlung | |
|---|---|---|---|
| Bestandteil | -Kern | Positron
Elektron |
Elektromagnetische Strahlung, -Quant |
| Zerfallsart |  |
  |
 |
| Reaktion |
|
||
| Beispiel |
|
||
| Energiespektrum | 
|

|

|
| Typischer Energiebereich | 2…5 MeV | Emax: einige keV bis einige MeV | ~ MeV |
| Reichweite (Luft) | wenige Zentimeter | einige Meter | sehr weit |
| Abschirmung | Papier | Blech | Blei, Beton (mehrere Dezimeter), exponentielle Abschwächung |
| Radiotoxizität | sehr hoch | hoch | gering |

Detektion Radioaktiver Strahlung

Zerfallsgesetz, Halbwertszeit und Aktivität
Wann zerfällt ein Atomkern? Eine Aussage lässt sich nur im Rahmen von Wahrscheinlichkeiten treffen (vergl. Quantenmechanik). Für eine hinreichend große Anzahl von Kernen findet man, dass die Anzahl der Zerfälle und damit die Änderung/Abnahme von proportional zur Beobachtungszeit und der Anzahl der vorhandenen Kerne ist. Mit der Konstanten können wir also schreiben:
Diese Beziehung gilt nur für Zeiten , in denen sich die Anzahl nicht wesentlich ändert. Dies ist in jedem Fall für infinitesimal kurze Zeiten der Fall. Wir schreiben:
- .
Die Änderungsrate ist also proportional zur Anzahl der vorhandenen Kerne und wir können die Differentialgleichung (DGL) mit dem Ansatz , wobei und zu bestimmende Konstanten sind, lösen. Alternativ schreiben wir:
- .
Wir integrieren beide Seiten vom Zeitpunkt , an dem Kerne vorhanden sein sollen, bis zum Zeitpunkt mit Kernen:
- .
Zerfallsgesetz

Für die Zerfallskonstante wählen wir das Inverse einer Zeit, damit sich die Einheiten kürzen: . Damit erhalten wir das Zerfallsgesetz: Physik Oberstufe: Vorlage:Hervorhebung Nach der Zeit ist nur noch der Bruchteil der ursprünglichen Kernanzahl vorhanden.
Halbwertszeit
Die Halbwertszeit ist so definiert, dass nach ihrem Ablauf nur noch die Hälfte der anfangs vorhandenen Kerne vorhanden ist. Man findet:
- .
Aktivität
Als Aktivität bezeichnet man die Anzahl der Zerfälle pro Zeiteinheit: Physik Oberstufe: Vorlage:Hervorhebung
Zerfallsreihen


Zerfällt ein instabiler Kern (Mutterkern), so ist der resultierende Tochterkern nicht notwendigerweise stabil. Ein instabiler Tochterkern zerfällt seiner Halbwertszeit entsprechend ebenfalls. So entsteht eine Zerfallsreihe, eine Kette von aufeinander folgenden Zerfällen, die erst bei einem stabilen Kern endet. Aus der Nuklidkarte kann man bei gegebenem Mutterkern die Zerfallskette konstruieren.
Massendefekt
Gedankenexperiment: Wir setzen einen -Kern aus Neutronen und Protonen zusammen und berechnen seine Masse:
- .


Vergleichen wir die aus den Komponenten berechnete Masse mit der gemessenen Masse eines -Teilchens, also eines -Kerns, so beobachten wir einen Massenverlust, den sog. Massendefekt :
- .
Eine Erklärung dieses Massendefekts liefert die Spezielle Relativitätstheorie mit der Äquivalenz von Masse und Energie: In einem abgeschlossenen System ist nicht notwendigerweise die Masse konstant, wohl aber die Energie, wenn man Ruhemassen gemäß der Formel berücksichtigt. Offensichtlich hat der -Kern eine geringere Energie als die einzelnen Bestandteile, und zwar:
- .
Pro Nukleon werden also bei der Bildung des Kerns ca. Energie frei. Umgekehrt ist diese Energie (pro Nukleon) nötig, um den Kern wieder in seine Bestandteile zu zerlegen. Man bezeichnet darum auch als Bindungsenergie des Kerns.
Kernreaktionen
Kernspaltung



Lise Meitner et. al

